El “atajo” que la FDA evalúa para obtener más vacunas contra el COVID-19 destinadas a adolescentes
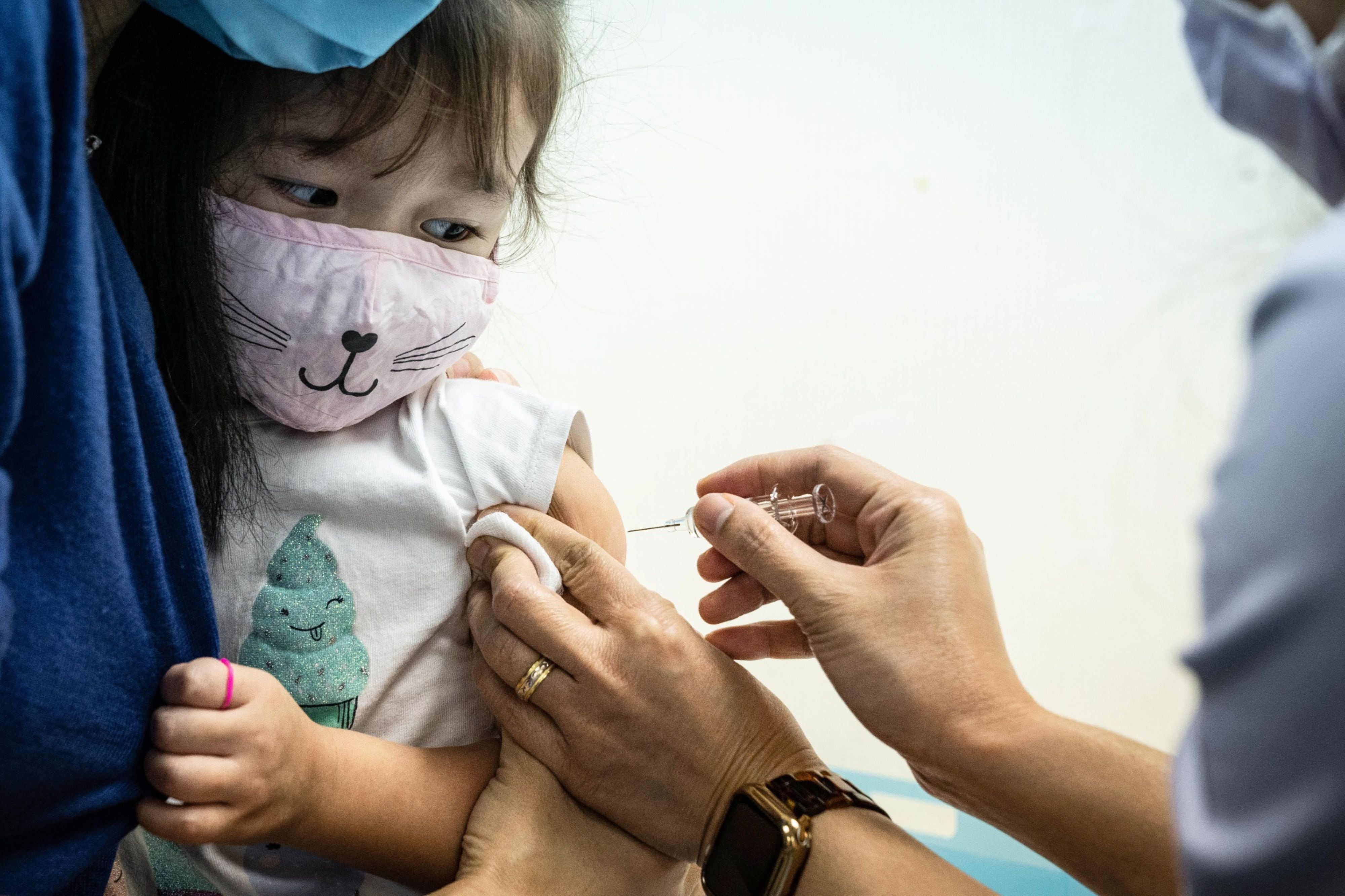
La agencia regulatoria de salud de los Estados Unidos FDA advirtió hoy en un comunicado que los niños en ensayos clínicos que prueban las vacunas COVID-19 deben ser monitoreados durante al menos dos meses para detectar efectos secundarios, lo que sugiere que la agencia está considerando un “atajo” o camino más rápido para autorizar la inyección para uso de emergencia que el establecido para la aprobación total.
La Administración de Drogas y Alimentos de EE. UU. afirmó este viernes que se encuentra en el proceso de completar la revisión de datos lo más rápido posible, probablemente en cuestión de semanas en lugar de meses.
La FDA otorgó la aprobación completa el mes pasado para el uso de la vacuna de Pfizer BioNTech en personas mayores de 16 años en base a un seguimiento de seis meses del ensayo. La inyección fue autorizada en diciembre para uso de emergencia en base a un seguimiento más corto de dos meses.

La agencia está bajo presión para aprobar una vacuna para niños menores de 12 años en medio de un aumento en las infecciones impulsadas por la propagación de la variante del coronavirus Delta en los Estados Unidos, fenómeno que ha interrumpido la reapertura de escuelas.
Pfizer y su socio BioNTech, así como Moderna, están compitiendo para enviar datos clínicos que buscan la aprobación regulatoria para sus vacunas en niños menores de 12 años.
La vacuna de Pfizer / BioNTech está actualmente autorizada para niños de 12 a 15 años en los Estados Unidos.
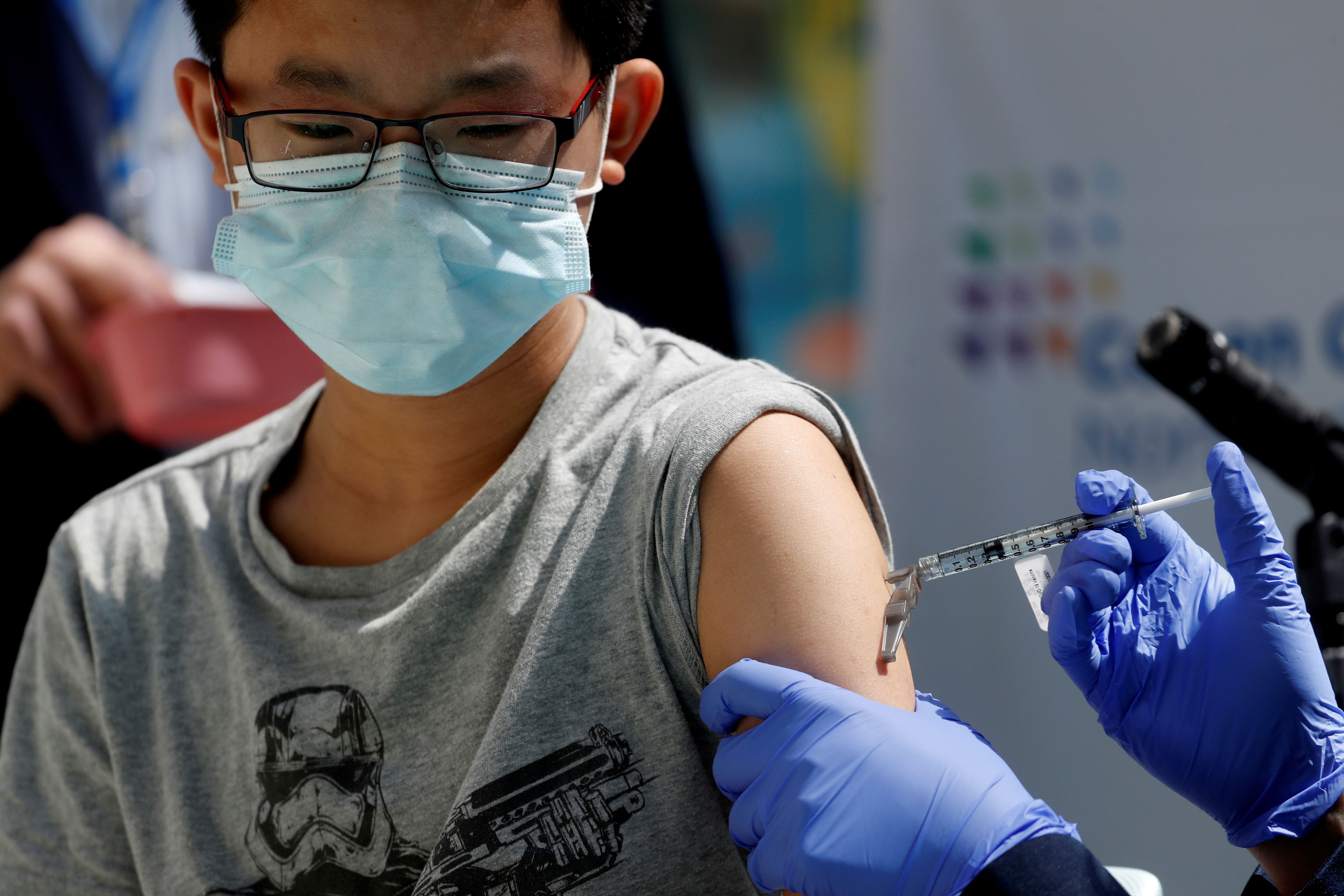
Pfizer dijo que espera informar los datos necesarios para su aprobación en niños de cinco y 11 años en algún momento de este mes y podría presentar una solicitud para uso de emergencia poco después. La farmacéutica dijo que los datos para niños de dos y menores de cinco años podrían llegar poco después.
Para los niños de entre seis meses y dos años, Pfizer adelantó que podría tener datos de seguridad e inmunogenicidad a partir de octubre o noviembre.
Moderna dijo este jueves que había inscrito completamente a los participantes en un ensayo que probaba su inyección en niños de entre seis y 11 años y que todavía estaba realizando estudios de selección de dosis para grupos de edad más jóvenes.
Consultado recientemente por Infobae, Rodrigo Sini de Almeida, desde San Pablo, Brasil, director de asuntos médicos de vacunas para América Latina de Pfizer, manifestaba en relación a este tipo de “atajos”: “Para avanzar en la vacunación a pediátricos, en América Latina hoy existe un marco regulatorio que es importante: en países como Brasil, Uruguay y Chile ya está aprobada el uso de la vacuna de la plataforma de ARN mensajero de Pfizer-Biontech a partir de los 12 años de edad. Para bajar de edad, necesitamos recolectar más información no solo de niños, sino de otras poblaciones vulnerables. Cuando hablamos de un estudio de 6 meses hasta 12 años, necesitamos hacer Fase I, Fase II y Fase III. Ahora estamos en la Fase II/III porque ya logramos resultados en Fase I. Incluso entendiendo más las características de tolerabilidad y seguridad, en los diferentes rangos de edad”.
Vacunar a pediátricos, ¿sí o no? Los expertos en infectología reúnen evidencia acerca de que “los beneficios para la salud de la vacunación universal en niños y jóvenes menores de 18 años contra el COVID-19 no superan los riesgos potenciales”. Los científicos también consideraron que el riesgo de COVID prolongado si bien existe es muy bajo en los niños.
Consultado en julio por Infobae, Omar Tabacco (MN 174475), médico pediatra y presidente de la prestigiosa Sociedad Argentina de Pediatría (SAP) proponía vacunar a los pediátricos para cortar la transmisibilidad del virus y a la vez como elemento de protección para “los pacientitos vulnerables o con comorbilidades”.
SEGUIR LEYENDO:
A pedido de la FDA, Pfizer y Moderna amplían el estudio de sus vacunas en niños de 5 a 11 años